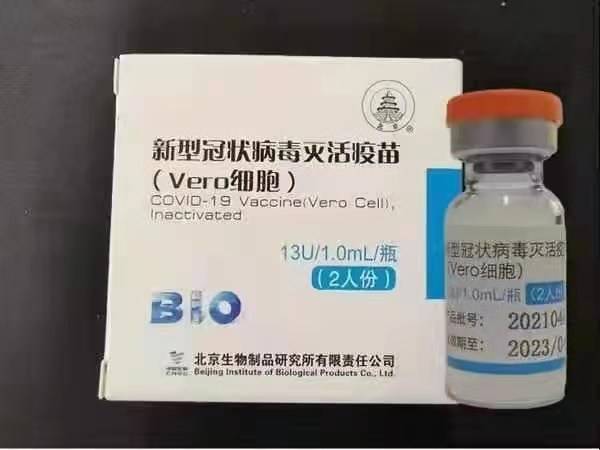
Sinopharm (Peking): BBIBP-CorV
PHASE 1
1 Testversion
ChiCTR2000032459
China
PHASE 2
2 Versuche
NCT04962906
Argentinien
ChiCTR2000032459
China
PHASE 3
6 Versuche
NCT04984408
ChiCTR2000034780
Vereinigte Arabische Emirate
NCT04612972
Peru
NCT04510207
Bahrain, Ägypten, Jordanien, Vereinigte Arabische Emirate
NCT04560881, BIBP2020003AR
Argentinien
NCT04917523
Vereinigte Arabische Emirate
Zulassungen
WHO-Notfallliste 59 Länder
Angola, Argentinien, Bahrain, Bangladesch, Weißrussland, Belize, Bolivien (Plurinationaler Staat), Brasilien, Brunei Darussalam, Kambodscha, Kamerun, Tschad, China, Komoren, Ägypten, Äquatorialguinea, Gabun, Gambia, Georgien, Guyana, Ungarn, Indonesien 、Iran (Islamische Republik)、Irak、Jordanien、Kirgisistan、Laotische Demokratische Volksrepublik
Libanon, Malaysia, Malediven, Mauretanien, Auritius, Mongolei, Montenegro, Marokko, Mosambik, Namibia, Nepal, Niger, Nordmazedonien, Pakistan, Paraguay, Peru, Philippinen, Republik Kongo, Enegal, Serbien, Seychellen, Solomonra, Leone Inseln、Somalia、Sri Lanka、Thailand、Trinidad und Tobago、Tunesien、Vereinigte Arabische Emirate、Venezuela (Bolivarische Republik)、Vietnam、Simbabwe
Sinopharm BBIBP-CorV COVID-19 ist ein inaktivierter Impfstoff, der aus in Kultur gezüchteten Viruspartikeln ohne pathogene Fähigkeit hergestellt wird. Dieser Impfstoffkandidat wurde von Sinopharm Holdings und dem Beijing Institute of Biological Products entwickelt.
Der Sinopharm BBIBP-CorV-Impfstoff funktioniert, indem er es dem Immunsystem ermöglicht, Antikörper gegen das SARS-CoV-2-Beta-Coronavirus zu produzieren. Inaktivierte Virusimpfstoffe werden seit Jahrzehnten verwendet, wie beispielsweise der Tollwutimpfstoff und der Hepatitis-A-Impfstoff. Diese Entwicklungstechnologie wurde erfolgreich auf viele bekannte Impfstoffe wie den Tollwutimpfstoff angewendet.
Der SARS-CoV-2-Stamm von Sinopharm (WIV04-Stamm und Bibliotheksnummer MN996528) wurde von einem Patienten im Jinyintan-Krankenhaus in Wuhan, China, isoliert. Das Virus wurde in einer kompetenten Vero-Zelllinie in Kultur vermehrt, und der Überstand der infizierten Zellen wurde 48 Stunden lang mit β-Propiolacton (1:4000 Vol./Vol., 2 bis 8ºC) inaktiviert. Nach Klärung der Zelltrümmer und Ultrafiltration wurde eine zweite β-Propiolacton-Inaktivierung unter den gleichen Bedingungen wie die erste Inaktivierung durchgeführt. Nach Angaben der WHO wurde der Impfstoff an 0,5 mg Alaun adsorbiert und in 0,5 ml steriler phosphatgepufferter Kochsalzlösung ohne Konservierungsstoffe in vorgefüllte Spritzen gefüllt.
Am 31. Dezember 2020 gab die State Drug Administration die Zulassung des von Sinopharm entwickelten experimentellen Impfstoffs bekannt.
Mai 2021 gab die Weltgesundheitsorganisation die Zulassung des Impfstoffs bekannt. Die Notfallverwendungsliste der WHO ermöglichte es den Ländern, ihre eigenen behördlichen Genehmigungen für die Einfuhr und Verabreichung von COVID-19-Impfstoffen zu beschleunigen. Auch die beratende Expertengruppe der WHO für Impfstrategien hat ihre Überprüfung des Impfstoffs abgeschlossen. Basierend auf allen verfügbaren Erkenntnissen empfiehlt die WHO zwei Impfdosen im Abstand von drei bis vier Wochen für Erwachsene ab 18 Jahren. Die Wirksamkeit des Impfstoffs gegen symptomatische und hospitalisierte Erkrankungen wird für alle Altersgruppen zusammen auf 79 % geschätzt.
Die American Medical Association veröffentlichte am 26. Erwachsene Die 2 inaktivierten SARS-CoV-2-Impfstoffe, die in dieser vorab festgelegten Zwischenanalyse randomisierter klinischer Studien verabreicht wurden, reduzierten das Risiko einer symptomatischen COVID-19 signifikant, und schwerwiegende Nebenwirkungen waren selten. In dieser randomisierten Phase-3-Studie an Erwachsenen betrug die Wirksamkeit der beiden inaktivierten Ganzvirus-Impfstoffe bei symptomatischen COVID-19-Fällen 72,8% bzw. 78,1%. Bei 2 Impfstoffen traten seltene schwerwiegende unerwünschte Ereignisse mit ähnlicher Häufigkeit auf wie bei der Kontrollgruppe, die nur aus Alaun bestand, und die meisten standen in keinem Zusammenhang mit der Impfung. Eine explorative Analyse ergab, dass die beiden Impfstoffe messbare neutralisierende Antikörper induzierten, ähnlich den Ergebnissen der Phase 1/2-Studie.
Die SAGE-Arbeitsgruppe der WHO hat am 10. Mai 2021 eine Überprüfung des Impfstoffs Sinopharm/BBIBP COVID-19 veröffentlicht Überhitzung. Infolgedessen Schäden, berichtete GAVI am 14. Mai 2021. Smart Labels, hergestellt von Zebra Technologies und hergestellt von Temptime Corporation, bestehen aus einem Kreis mit einem helleren Quadrat in der Mitte, aus einer farblosen Chemikalie, die im Laufe der Zeit irreversibel Farbe entwickelt. . Dieser wird dunkler, um einen visuellen Hinweis auf die kumulative Hitzeeinwirkung zu geben. Sobald die Durchstechflasche einer Hitze ausgesetzt wurde, die über ihren optimalen Lagerbereich hinausgeht, wird das Quadrat dunkler als der Kreis, was darauf hinweist, dass der Impfstoff nicht mehr verwendet werden sollte.
Registrierungsnummer der National Drug BBIBP-CorV COVID-19-Impfstoff-Medikamentenbibliothek: DB15807.